2018年江西省上饒市中考化學(xué)模擬沖刺題(精編解析版)
由于版式的問題,試題可能會(huì)出現(xiàn)亂碼的現(xiàn)象,為了方便您的閱讀請(qǐng)點(diǎn)擊全屏查看
一.選擇題
1.某同學(xué)用托盤天平稱量固體物質(zhì)時(shí),把固體物質(zhì)放在右盤,砝碼放在左盤,稱得固體物質(zhì)的質(zhì)量為10.8 g(1克以下用游碼),如果按正確的方法稱量,這位同學(xué)所稱固體的實(shí)際質(zhì)量是()
A.9.2 g????????????? B.9.8 g????????????? C.10.8 g????????????? D.10.2 g
2.A、B、C三種物質(zhì)各15g,它們化合時(shí)只能生成30g新物質(zhì)D.若增加10gA,則反應(yīng)停止后,原反應(yīng)物種只余C.根據(jù)上述條件推斷下列說(shuō)法正確的是()
A.第一次反應(yīng)停止后,B剩余9g
B.第二次反應(yīng)后,D的質(zhì)量為40g
C.反應(yīng)中A和B的質(zhì)量比是3﹕2
D.反應(yīng)中A和C的質(zhì)量比是5﹕2
3.已知一個(gè)SO2分子的質(zhì)量為n克,一個(gè)SO3分子的質(zhì)量為m克,若以氧原子質(zhì)量的![]() 作為相對(duì)原子質(zhì)量的標(biāo)準(zhǔn),則SO3的相對(duì)分子質(zhì)量()
作為相對(duì)原子質(zhì)量的標(biāo)準(zhǔn),則SO3的相對(duì)分子質(zhì)量()
A.![]() ????????????? B.
????????????? B.![]() ????????????? C.
????????????? C.![]() ????????????? D.
????????????? D.![]()
4.某反應(yīng)2A+2B→2C,其中A和C有如圖所示的質(zhì)量關(guān)系.當(dāng)有20gC生成時(shí),消耗B的質(zhì)量為(B的相對(duì)分子質(zhì)量為30)()
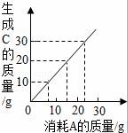
A.10g????????????? B.5g????????????? C.15g????????????? D.13g
5.氯酸鉀和二氧化錳的混合物共A克,加熱完全反應(yīng)后得到B克氧氣和C克氯化鉀,則混合物中二氧化錳的質(zhì)量為()
A.(A+B﹣C)克????????????? B.(A﹣B﹣C)克????????????? C.(A+B+C)克????????????? D.(A+C)克
6.氫氣和氧氣的混合物共20g在一密閉容器內(nèi)點(diǎn)燃,充分反應(yīng)后生成18g水.則原混合物中氫氣質(zhì)量為()
A.2g????????????? B.4g????????????? C.2g或4g????????????? D.無(wú)法確定
二.填空題
7.(14分)用化學(xué)用語(yǔ)填空
(1)相對(duì)分子質(zhì)量最小的氧化物:
(2)保持硫酸銅化學(xué)性質(zhì)的粒子:
(3)高錳酸根離子:
(4)畫出He﹣3的結(jié)構(gòu)示意圖:
(5)碳酸鈣的化學(xué)式為
(6)巖石呈紅色是含氫氧化鐵所致,氫氧化鐵原子團(tuán)的化合價(jià).
(7)標(biāo)出KClO3中氯元素的化合價(jià).
8.配平下列化學(xué)方程式
(1)CuFeS2+O2═CuO+Fe2O3+SO2
(2)C5H12+O2═CO2+H2O.
9.有機(jī)物的命名與它的構(gòu)成規(guī)律緊密相關(guān).如有機(jī)物甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8),按此規(guī)律,丁烷的化學(xué)式為.
10.工業(yè)鹽酸常含有少量的三氯化鐵,若其中H+與Cl﹣的個(gè)數(shù)比為94:97,則Fe3+與Cl﹣的個(gè)數(shù)比為.
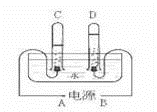
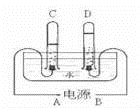
11.阿伏加德羅曾經(jīng)總結(jié)出一條定律:在同溫同壓下,同體積的任何氣體都含有相同的分子數(shù).如圖是實(shí)驗(yàn)室電解水的簡(jiǎn)易裝置示意圖.
①接通直流電源后,B電極為電源的極,C管中的氣體是氣
②C、D兩試管內(nèi)氣體的體積比為.
③電解水反應(yīng)的化學(xué)方程式:.
④水電解過(guò)程中,發(fā)生變化的微粒是,不發(fā)生變化的微粒是和.(均填名稱)
12.將14.0g硫在一定量的氧氣中燃燒,記錄如下數(shù)據(jù):
實(shí)驗(yàn)次數(shù) | 1 | 2 | 3 |
氧氣的質(zhì)量/g | 4.5 | 14.0 | 18.0 |
二氧化硫的質(zhì)量/g | 9.0 | 28.0 | 28.0 |
分析數(shù)據(jù),回答下列問題.
(1)在這三次實(shí)驗(yàn)中,第次剛好完全反應(yīng).
(2)在第次實(shí)驗(yàn)中硫有剩余,剩余g.在第次實(shí)驗(yàn)中氧氣有剩余,剩余g.若將剩余的硫在剩余的氧氣中燃燒,可生成二氧化硫g.
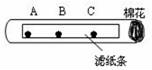
13.如圖所示,在試管中的濾紙條上A、B、C三處各滴上一滴無(wú)色酚酞,再向試管口的棉花團(tuán)上滴一些濃氨水.
(1)實(shí)驗(yàn)中,可以觀察到A、B、C三處的酚酞溶液由(填A(yù)、B、C或(C、B、A)順序先后變成色.該實(shí)驗(yàn)說(shuō)明分子的性質(zhì)是.
(2)實(shí)驗(yàn)中,往往在試管下放一張白紙,白紙的作用是.
三.探究題
14.某興趣小組同學(xué)對(duì)實(shí)驗(yàn)室制取氧氣的條件進(jìn)行如下探究實(shí)驗(yàn).
①為探究催化劑的種類對(duì)氯酸鉀分解速度的影響,甲設(shè)計(jì)以下對(duì)比試驗(yàn):
Ⅰ.將3.0g KClO3與1.0g MnO2均勻混合加熱
Ⅱ.將xg KClO3與1.0g CuO均勻混合加熱
在相同溫度下,比較兩組實(shí)驗(yàn)產(chǎn)生O2的快慢.
Ⅰ中反應(yīng)的化學(xué)方程式是;Ⅱ中x的值為.
②乙探究了影響雙氧水分解速度的某種因素,實(shí)驗(yàn)數(shù)據(jù)記錄如表:
| 雙氧水的質(zhì)量 | 雙氧水的濃度 | MnO2的質(zhì)量 | 相同時(shí)間內(nèi)產(chǎn)生O2的體積 |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本實(shí)驗(yàn)中,測(cè)量O2的裝置是(填序號(hào)).

實(shí)驗(yàn)結(jié)論:在相同條件下,,雙氧水分解得快.
丙用如圖裝置進(jìn)行實(shí)驗(yàn),通過(guò)比較也能達(dá)到實(shí)驗(yàn)?zāi)康模?/p>
2018年江西省上饒市中考化學(xué)模擬沖刺題參考答案與試題解析
一.選擇題
1.某同學(xué)用托盤天平稱量固體物質(zhì)時(shí),把固體物質(zhì)放在右盤,砝碼放在左盤,稱得固體物質(zhì)的質(zhì)量為10.8 g(1克以下用游碼),如果按正確的方法稱量,這位同學(xué)所稱固體的實(shí)際質(zhì)量是()
A.9.2 g????????????? B.9.8 g????????????? C.10.8 g????????????? D.10.2 g
【考點(diǎn)】稱量器-托盤天平.
【專題】結(jié)合課本知識(shí)的信息.
【分析】根據(jù)天平的使用方法是左物右碼,可知左盤的質(zhì)量等于右盤的質(zhì)量加游碼的質(zhì)量,即物體質(zhì)量=砝碼質(zhì)量+游碼質(zhì)量,如果放錯(cuò)了,還要根據(jù)左盤的質(zhì)量=右盤的質(zhì)量+游碼的質(zhì)量,只不過(guò)砝碼與物體位置交換了,列等式進(jìn)行計(jì)算.
【解答】解:由左盤的質(zhì)量=右盤的質(zhì)量+游碼的質(zhì)量可知:砝碼質(zhì)量=物體質(zhì)量+游碼的質(zhì)量,所以物碼反放時(shí)物體質(zhì)量=砝碼質(zhì)量﹣游碼質(zhì)量,即:物體質(zhì)量=10.0 g﹣0.8 g=9.2 g.
故選A.
【點(diǎn)評(píng)】在計(jì)算有關(guān)天平的題目時(shí),要謹(jǐn)記左盤的質(zhì)量═右盤的質(zhì)量+游碼的質(zhì)量,由此列等式計(jì)算,不管是左物右碼還是左碼右物,都可以算.
2.A、B、C三種物質(zhì)各15g,它們化合時(shí)只能生成30g新物質(zhì)D.若增加10gA,則反應(yīng)停止后,原反應(yīng)物種只余C.根據(jù)上述條件推斷下列說(shuō)法正確的是()
A.第一次反應(yīng)停止后,B剩余9g
B.第二次反應(yīng)后,D的質(zhì)量為40g
C.反應(yīng)中A和B的質(zhì)量比是3﹕2
D.反應(yīng)中A和C的質(zhì)量比是5﹕2
【考點(diǎn)】質(zhì)量守恒定律及其應(yīng)用.
【專題】化學(xué)用語(yǔ)和質(zhì)量守恒定律.
【分析】若增加10gA,則反應(yīng)停止后原反應(yīng)物中只余C,說(shuō)明此時(shí)反應(yīng)掉的A為25g,B為15g,而在加入10gA前,A15g完全反應(yīng)生成了30g的D.可以推知當(dāng)25gA完全反應(yīng)時(shí)生成的D為50g(為反應(yīng)物A的質(zhì)量的2倍),所以可以推知當(dāng)25gA和15B反應(yīng)時(shí)消耗的C的質(zhì)量為50g﹣25g﹣15g=10g.
【解答】解:由題意,若增加10gA,則反應(yīng)停止后原反應(yīng)物中只余C,說(shuō)明參加第二次反應(yīng)的A的質(zhì)量為25克,B的質(zhì)量為15克,A與B參加反應(yīng)的質(zhì)量比為5:3;
A、B、C三種物質(zhì)各15g,它們化合時(shí)只能生成30g新物質(zhì)D,說(shuō)明參加第一次反應(yīng)的A的質(zhì)量為15克,B的質(zhì)量為9克,根據(jù)質(zhì)量守恒定律可知參加第一次反應(yīng)的C的質(zhì)量為6克,又生成D的質(zhì)量是30g,則反應(yīng)中A、B、C、D的質(zhì)量比為5:3:2:10,則第二次參加反應(yīng)的C的質(zhì)量為10克.
A、參加第一次反應(yīng)的B的質(zhì)量為9克,剩余6克.故不正確;
B、第二次參加反應(yīng)的A的質(zhì)量為25克,故第二次反應(yīng)后D的質(zhì)量是50g.故不正確;
C、反應(yīng)中A與B的質(zhì)量比為5:3.故不正確.
D、反應(yīng)中A與C的質(zhì)量比為5:2.故正確;
故選D.
【點(diǎn)評(píng)】質(zhì)量守恒定律的應(yīng)用是中考考查的重點(diǎn),本題考查的是靈活運(yùn)用質(zhì)量守恒定律的思想處理問題的能力.
3.已知一個(gè)SO2分子的質(zhì)量為n克,一個(gè)SO3分子的質(zhì)量為m克,若以氧原子質(zhì)量的![]() 作為相對(duì)原子質(zhì)量的標(biāo)準(zhǔn),則SO3的相對(duì)分子質(zhì)量()
作為相對(duì)原子質(zhì)量的標(biāo)準(zhǔn),則SO3的相對(duì)分子質(zhì)量()
A.![]() ????????????? B.
????????????? B.![]() ????????????? C.
????????????? C.![]() ????????????? D.
????????????? D.![]()
【考點(diǎn)】相對(duì)分子質(zhì)量的概念及其計(jì)算.
【專題】化學(xué)式的計(jì)算.
【分析】1個(gè)氧原子的質(zhì)量為:(m﹣n)g;1個(gè)硫原子的質(zhì)量為:n﹣2(m﹣n)g;根據(jù)相對(duì)原子質(zhì)量的求法,進(jìn)行分析求出SO3的相對(duì)分子質(zhì)量.
【解答】解:1個(gè)氧原子的質(zhì)量為:(m﹣n)g;?
氧原子的相對(duì)原子質(zhì)量為: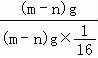 =16;
=16;
1個(gè)硫原子的質(zhì)量為:n﹣2(m﹣n)g;
硫原子的相對(duì)原子質(zhì)量為: =
=![]()
根據(jù)相對(duì)分子的質(zhì)量為組成分子的各原子的相對(duì)原子質(zhì)量之和,所以SO3的相對(duì)分子質(zhì)量為![]() +16×3=
+16×3=![]() .
.
故選A.
【點(diǎn)評(píng)】本題考查學(xué)生對(duì)相對(duì)原子質(zhì)量計(jì)算方法的理解與掌握,并能在解題中靈活應(yīng)用的能力.
4.某反應(yīng)2A+2B→2C,其中A和C有如圖所示的質(zhì)量關(guān)系.當(dāng)有20gC生成時(shí),消耗B的質(zhì)量為(B的相對(duì)分子質(zhì)量為30)()
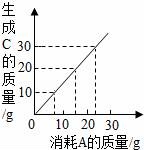
A.10g????????????? B.5g????????????? C.15g????????????? D.13g
【考點(diǎn)】根據(jù)化學(xué)反應(yīng)方程式的計(jì)算.
【專題】有關(guān)化學(xué)方程式的計(jì)算.
【分析】據(jù)圖象可知:參加反應(yīng)的A和生成C的質(zhì)量比,并結(jié)合質(zhì)量守恒定律分析解答,在計(jì)算質(zhì)量時(shí)與化學(xué)式前面的系數(shù)無(wú)關(guān).
【解答】解:由圖可知:當(dāng)參加反應(yīng)的A約是15g時(shí),生成的C的質(zhì)量是20g,所以消耗B的質(zhì)量為:20g﹣15g=5g;
故選B.
【點(diǎn)評(píng)】本題考查了學(xué)生對(duì)于質(zhì)量守恒定律的掌握及對(duì)圖象的分析,考查了學(xué)生分析解決問題的能力.
5.氯酸鉀和二氧化錳的混合物共A克,加熱完全反應(yīng)后得到B克氧氣和C克氯化鉀,則混合物中二氧化錳的質(zhì)量為()
A.(A+B﹣C)克????????????? B.(A﹣B﹣C)克????????????? C.(A+B+C)克????????????? D.(A+C)克
【考點(diǎn)】質(zhì)量守恒定律及其應(yīng)用.
【專題】化學(xué)用語(yǔ)和質(zhì)量守恒定律.
【分析】氯酸鉀在二氧化錳的催化作用下生成氯化鉀和氧氣,反應(yīng)前后二氧化錳的質(zhì)量不變;由題意,氯酸鉀和二氧化錳的混合物共A克,加熱完全反應(yīng)后得到B克氧氣和C克氯化鉀,由質(zhì)量守恒定律計(jì)算出參加反應(yīng)的氯酸鉀的質(zhì)量,進(jìn)而可計(jì)算出混合物中二氧化錳的質(zhì)量.
【解答】解:氯酸鉀在二氧化錳的催化作用下生成氯化鉀和氧氣,反應(yīng)前后二氧化錳的質(zhì)量不變;由題意,氯酸鉀和二氧化錳的混合物共A克,加熱完全反應(yīng)后得到B克氧氣和C克氯化鉀,則混合物中氯酸鉀的質(zhì)量為(B+C)g,故混合物中二氧化錳的質(zhì)量為Ag﹣(B+C)g=(A﹣B﹣C)g.
故選:B.
【點(diǎn)評(píng)】本題難度不大,掌握質(zhì)量守恒定律并能靈活運(yùn)用是正確解答本題的關(guān)鍵.
6.氫氣和氧氣的混合物共20g在一密閉容器內(nèi)點(diǎn)燃,充分反應(yīng)后生成18g水.則原混合物中氫氣質(zhì)量為()
A.2g????????????? B.4g????????????? C.2g或4g????????????? D.無(wú)法確定
【考點(diǎn)】根據(jù)化學(xué)反應(yīng)方程式的計(jì)算.
【專題】有關(guān)化學(xué)方程式的計(jì)算.
【分析】根據(jù)充分反應(yīng)后生成18g水,利用化學(xué)反應(yīng)方程式可知,2g氫氣和16g氧氣恰好完全反應(yīng)生成18g水,則20g混合氣體有剩余的氣體存在,則有兩種可能:①剩余氣體為氫氣;②剩余氣體為氧氣來(lái)分析解答.
【解答】解:設(shè)參加反應(yīng)反應(yīng)的氫氣和氧氣的質(zhì)量分別為x、y.
2H2+O2![]() 2H2O
2H2O
4?? 32????? 36
x????? y??? 18g
![]()
x=2g,y=16g
①若剩余氣體為氫氣,則氫氣的質(zhì)量為2g+(20g﹣18g)=4g,即混合氣體中有4g氫氣和16g氧氣;
②若剩余氣體為氧氣,則氧氣的質(zhì)量為16g+(20g﹣18g)=18g,即混合氣體中有2g氫氣和18g氧氣.
故為:4g或2g.
故選:C.
【點(diǎn)評(píng)】本題考查學(xué)生利用化學(xué)反應(yīng)方程式的計(jì)算來(lái)分析混合物的成分,學(xué)生應(yīng)能利用化學(xué)反應(yīng)判斷恰好完全反應(yīng)的量,要注意過(guò)量計(jì)算過(guò)程的思維訓(xùn)練.
二.填空題
7.(14分)用化學(xué)用語(yǔ)填空
(1)相對(duì)分子質(zhì)量最小的氧化物: H2O(2)保持硫酸銅化學(xué)性質(zhì)的粒子: Cu2+、SO42﹣(3)高錳酸根離子: MnO4﹣(4)畫出He﹣3的結(jié)構(gòu)示意圖:  (5)碳酸鈣的化學(xué)式為 CaCO3(6)巖石呈紅色是含氫氧化鐵所致,氫氧化鐵原子團(tuán)的化合價(jià) Fe(
(5)碳酸鈣的化學(xué)式為 CaCO3(6)巖石呈紅色是含氫氧化鐵所致,氫氧化鐵原子團(tuán)的化合價(jià) Fe(![]() )3 .
)3 .
(7)標(biāo)出KClO3中氯元素的化合價(jià) K![]() O3 .
O3 .
【考點(diǎn)】化學(xué)符號(hào)及其周圍數(shù)字的意義;原子結(jié)構(gòu)示意圖與離子結(jié)構(gòu)示意圖.
【專題】化學(xué)用語(yǔ)和質(zhì)量守恒定律.
【分析】本題考查化學(xué)用語(yǔ)的意義及書寫,解題關(guān)鍵是分清化學(xué)用語(yǔ)所表達(dá)的對(duì)象是分子、原子、離子還是化合價(jià),才能在化學(xué)符號(hào)前或其它位置加上適當(dāng)?shù)挠?jì)量數(shù)來(lái)完整地表達(dá)其意義,并能根據(jù)物質(zhì)化學(xué)式的書寫規(guī)則正確書寫物質(zhì)的化學(xué)式,才能熟練準(zhǔn)確的解答此類題目.
【解答】解:(1)相對(duì)分子質(zhì)量最小的氧化物是水,故填:H2O;
(2)保持硫酸銅化學(xué)性質(zhì)的粒子是銅離子和硫酸根離子,故填:Cu2+、SO42﹣;
(3)高錳酸根離子帶有1個(gè)單位的負(fù)電荷,故填:MnO4﹣,故填:MnO4﹣;
(4)He﹣3的結(jié)構(gòu)示意圖就是氦原子結(jié)構(gòu)示意圖,故填: ;
;
(5)碳酸鈣的化學(xué)式為CaCO3;故填:CaCO3;
(6)氫氧化鐵中原子團(tuán)是氫氧根,其化合價(jià)為﹣1,故填:Fe(![]() )3.
)3.
(7)KClO3中氯元素的化合價(jià)為+5,故填:K![]() O3.
O3.
【點(diǎn)評(píng)】本題主要考查學(xué)生對(duì)化學(xué)用語(yǔ)的書寫和理解能力,題目設(shè)計(jì)既包含對(duì)化學(xué)符號(hào)意義的了解,又考查了學(xué)生對(duì)化學(xué)符號(hào)的書寫,考查全面,注重基礎(chǔ),題目難度較易.
8.配平下列化學(xué)方程式
(1) 4 CuFeS2+ 13 O2═ 4 CuO+ 2 Fe2O3+ 8 SO2
(2) 1 C5H12+ 8 O2═ 5 CO2+ 6 H2O.
【考點(diǎn)】化學(xué)方程式的配平.
【專題】元素質(zhì)量守恒;化學(xué)用語(yǔ)和質(zhì)量守恒定律.
【分析】根據(jù)質(zhì)量守恒定律:反應(yīng)前后各原子的數(shù)目不變,選擇相應(yīng)的配平方法(最小公倍數(shù)法、定一法等)進(jìn)行配平即可;配平時(shí)要注意化學(xué)計(jì)量數(shù)必須加在化學(xué)式的前面,配平過(guò)程中不能改變化學(xué)式中的下標(biāo);配平后化學(xué)計(jì)量數(shù)必須為整數(shù).
【解答】解:(1)本題可利用“定一法”進(jìn)行配平,把CuFeS2的化學(xué)計(jì)量數(shù)定為1,則O2、CuO、Fe2O3、SO2前面的化學(xué)計(jì)量數(shù)分別為:![]() 、1、
、1、![]() 、2,同時(shí)擴(kuò)大4倍,則CuFeS2、O2、CuO、Fe2O3、SO2前面的化學(xué)計(jì)量數(shù)分別為13、4、2、8.
、2,同時(shí)擴(kuò)大4倍,則CuFeS2、O2、CuO、Fe2O3、SO2前面的化學(xué)計(jì)量數(shù)分別為13、4、2、8.
(2)本題可利用“定一法”進(jìn)行配平,把C5H12的化學(xué)計(jì)量數(shù)定為1,則O2、CO2、H2O前面的化學(xué)計(jì)量數(shù)分別為:8、5、6.
故答案為:(1)4、13、4、2、8;(2)1、8、5、6.
【點(diǎn)評(píng)】本題難度不大,配平時(shí)化學(xué)計(jì)量數(shù)必須加在化學(xué)式的前面,配平過(guò)程中不能改變化學(xué)式中的下標(biāo);配平后化學(xué)計(jì)量數(shù)必須為整數(shù),配平過(guò)程中若出現(xiàn)分?jǐn)?shù),必須把分?jǐn)?shù)去分母轉(zhuǎn)化為整數(shù).
9.有機(jī)物的命名與它的構(gòu)成規(guī)律緊密相關(guān).如有機(jī)物甲烷(CH4)、乙烷(C2H6)、丙烷(C3H8),按此規(guī)律,丁烷的化學(xué)式為 C4H10 .
【考點(diǎn)】化學(xué)式的書寫及意義;學(xué)習(xí)化學(xué)的重要途徑及學(xué)習(xí)方法.
【專題】結(jié)合課本知識(shí)的信息.
【分析】找出有機(jī)物的規(guī)律,名稱和碳原子的個(gè)數(shù)相對(duì)應(yīng),氫原子數(shù)目依次增加2.
【解答】解:由題意分析知道甲烷的碳原子數(shù)目為1,乙烷的碳原子數(shù)目為2,丙烷的為3,那丁烷的應(yīng)該為4;
氫原子數(shù)目乙烷比甲烷多2,丙烷比乙烷多2,那丁烷應(yīng)該比丙烷多2,應(yīng)為10;
所以答案為C4H10
【點(diǎn)評(píng)】根據(jù)所給的信息,自己會(huì)總結(jié)規(guī)律,解決問題.這需要學(xué)生在平常的學(xué)習(xí)中,善于總結(jié),善于運(yùn)用.
10.工業(yè)鹽酸常含有少量的三氯化鐵,若其中H+與Cl﹣的個(gè)數(shù)比為94:97,則Fe3+與Cl﹣的個(gè)數(shù)比為 1:97 .
【考點(diǎn)】分子、原子、離子、元素與物質(zhì)之間的關(guān)系.
【專題】物質(zhì)的微觀構(gòu)成與物質(zhì)的宏觀組成.
【分析】根據(jù)已有的知識(shí)進(jìn)行分析,溶液不顯電性,在溶液中陰離子和陽(yáng)離子所帶電荷數(shù)值相等.
【解答】解:H+與Cl﹣的個(gè)數(shù)比為94:97,則負(fù)電荷總數(shù)為97,氫離子所帶正電荷總數(shù)為94,要保證陰離子所帶負(fù)電荷數(shù)值與陽(yáng)離子所帶正電荷數(shù)值相等,則鐵離子需要提供3個(gè)正電荷,一個(gè)鐵離子帶三個(gè)正電荷,故鐵離子個(gè)數(shù)為1,所以Fe3+與Cl﹣的個(gè)數(shù)比為1:97.
答案:
【點(diǎn)評(píng)】本題考查了溶液中離子個(gè)數(shù)比的計(jì)算,完成此題,可以依據(jù)陰離子所帶負(fù)電荷總數(shù)與陽(yáng)離子所帶正電荷數(shù)值相等進(jìn)行.
11.阿伏加德羅曾經(jīng)總結(jié)出一條定律:在同溫同壓下,同體積的任何氣體都含有相同的分子數(shù).如圖是實(shí)驗(yàn)室電解水的簡(jiǎn)易裝置示意圖.
①接通直流電源后,B電極為電源的 正 極,C管中的氣體是 氫 氣
②C、D兩試管內(nèi)氣體的體積比為 2:1 .
③電解水反應(yīng)的化學(xué)方程式: 2H2O![]() 2H2↑+O2↑ .
2H2↑+O2↑ .
④水電解過(guò)程中,發(fā)生變化的微粒是 水分子 ,不發(fā)生變化的微粒是 氫原子 和 氧原子 .(均填名稱)
【考點(diǎn)】電解水實(shí)驗(yàn);書寫化學(xué)方程式.
【專題】空氣與水.
【分析】由電解水生成氣體是“負(fù)氫正氧”,且氧氣與氫氣的體積比是1:2,結(jié)合圖示所示的氣體體積進(jìn)行分析有關(guān)的問題.再根據(jù)分子、原子在化學(xué)變化中變化,分析在水電解過(guò)程中微粒的變化.
【解答】解:①由電解水的簡(jiǎn)易裝置示意圖可知,D試管中收集的氣體較少是氧氣,應(yīng)是電源的正極產(chǎn)生的氣體,所以,B電極為電源的正極.則C管中的氣體是氫氣.
②由電解水的簡(jiǎn)易裝置示意圖可知,C、D兩試管內(nèi)氣體的分別是氫氣和氧氣,體積比為2:1.
③電解水生成了氫氣和氧氣,反應(yīng)的化學(xué)方程式:2H2O![]() 2H2↑+O2↑.
2H2↑+O2↑.
④由于分子在化學(xué)變化中能再分,原子不能再分,所以,水電解過(guò)程中,發(fā)生變化的微粒是水分子,不發(fā)生變化的微粒是氫原子和氧原子.
故答為:①正,氫;②2:1;③2H2O![]() 2H2↑+O2↑;④水分子;氫原子;氧原子.
2H2↑+O2↑;④水分子;氫原子;氧原子.
【點(diǎn)評(píng)】要熟記正氧負(fù)氫,氫二氧一,電解水實(shí)驗(yàn)得到的結(jié)論有:水是由氫元素和氧元素組成等,以上這些常是解決此類題的關(guān)鍵.
12.將14.0g硫在一定量的氧氣中燃燒,記錄如下數(shù)據(jù):
實(shí)驗(yàn)次數(shù) | 1 | 2 | 3 |
氧氣的質(zhì)量/g | 4.5 | 14.0 | 18.0 |
二氧化硫的質(zhì)量/g | 9.0 | 28.0 | 28.0 |
分析數(shù)據(jù),回答下列問題.
(1)在這三次實(shí)驗(yàn)中,第 2 次剛好完全反應(yīng).
(2)在第 1 次實(shí)驗(yàn)中硫有剩余,剩余 9.5 g.在第 3 次實(shí)驗(yàn)中氧氣有剩余,剩余 4.0 g.若將剩余的硫在剩余的氧氣中燃燒,可生成二氧化硫 8.0 g.
【考點(diǎn)】根據(jù)化學(xué)反應(yīng)方程式的計(jì)算.
【專題】綜合計(jì)算(圖像型、表格型、情景型計(jì)算題).
【分析】根據(jù)硫燃燒的化學(xué)方程式可以計(jì)算硫和氧氣恰好完全反應(yīng)時(shí)的質(zhì)量比,進(jìn)一步可以判斷每次反應(yīng)的情況.
【解答】解:硫燃燒的化學(xué)方程式為:S+O2![]() SO2,
SO2,
反應(yīng)物和生成物的質(zhì)量關(guān)系為:32? 32???? 64
硫、氧氣、二氧化硫的質(zhì)量比為1:1:2;
(1)第2次實(shí)驗(yàn)中,14.0g氧氣和硫完全反應(yīng)時(shí)消耗硫的質(zhì)量為14.0g,恰好完全反應(yīng).
故填:2.
(2)第1次實(shí)驗(yàn)中,氧氣的質(zhì)量是4.5g,需要硫的質(zhì)量為4.5g,剩余硫的質(zhì)量為:14.0g﹣4.5g=9.5g;
第3次實(shí)驗(yàn)中,二氧化硫的質(zhì)量沒有增加,說(shuō)明沒有反應(yīng),氧氣剩余,剩余質(zhì)量為4.0g;
剩余的硫是9.5g,剩余的氧氣是4.0,充分反應(yīng)后氧氣剩余,則4.0g硫完全燃燒生成二氧化硫的質(zhì)量為8.0g.
故填:1;9.5;3;4.0;8.0.
【點(diǎn)評(píng)】本題主要考查學(xué)生運(yùn)用假設(shè)法和化學(xué)方程式進(jìn)行計(jì)算和推斷的能力.
13.如圖所示,在試管中的濾紙條上A、B、C三處各滴上一滴無(wú)色酚酞,再向試管口的棉花團(tuán)上滴一些濃氨水.
(1)實(shí)驗(yàn)中,可以觀察到A、B、C三處的酚酞溶液由 CBA (填A(yù)、B、C或(C、B、A)順序先后變成 紅 色.該實(shí)驗(yàn)說(shuō)明分子的性質(zhì)是 在不斷的運(yùn)動(dòng) .
(2)實(shí)驗(yàn)中,往往在試管下放一張白紙,白紙的作用是 起襯托作用,便于觀察濾紙條的顏色變化 .

【考點(diǎn)】分子的定義與分子的特性.
【專題】實(shí)驗(yàn)性簡(jiǎn)答題.
【分析】(1)根據(jù)實(shí)驗(yàn)現(xiàn)象進(jìn)行分析,氨水呈堿性,能使酚酞試液變紅,據(jù)此解答即可;
(2)實(shí)驗(yàn)中,往往在試管下放一張白紙,白紙的作用是起襯托作用,使現(xiàn)象更明顯.
【解答】解:(1)在試管中的濾紙條上A、B、C三處各滴上一滴無(wú)色酚酞溶液,試管口塞上一團(tuán)蘸有濃氨水的棉花,由于分子在不斷的運(yùn)動(dòng),故可以觀察到A、B、C三處的酚酞溶液變成紅色,先后順序?yàn)镃BA.該現(xiàn)象說(shuō)明分子在不斷的運(yùn)動(dòng).故填:CBA;紅;在不斷的運(yùn)動(dòng);
(2)在試管下放一張白紙的作用是便于觀察顏色的變化;故填:起襯托作用,便于觀察濾紙條的顏色變化.
【點(diǎn)評(píng)】本題考查了如何探究物質(zhì)的性質(zhì)和變化規(guī)律,掌握反應(yīng)現(xiàn)象與本質(zhì)的聯(lián)系,理解微粒觀點(diǎn)的應(yīng)用.
三.探究題
14.某興趣小組同學(xué)對(duì)實(shí)驗(yàn)室制取氧氣的條件進(jìn)行如下探究實(shí)驗(yàn).
①為探究催化劑的種類對(duì)氯酸鉀分解速度的影響,甲設(shè)計(jì)以下對(duì)比試驗(yàn):
Ⅰ.將3.0g KClO3與1.0g MnO2均勻混合加熱
Ⅱ.將xg KClO3與1.0g CuO均勻混合加熱
在相同溫度下,比較兩組實(shí)驗(yàn)產(chǎn)生O2的快慢.
Ⅰ中反應(yīng)的化學(xué)方程式是 2KClO3![]() 2KCl+3O2↑ ;Ⅱ中x的值為 3.0 .
2KCl+3O2↑ ;Ⅱ中x的值為 3.0 .
②乙探究了影響雙氧水分解速度的某種因素,實(shí)驗(yàn)數(shù)據(jù)記錄如表:
| 雙氧水的質(zhì)量 | 雙氧水的濃度 | MnO2的質(zhì)量 | 相同時(shí)間內(nèi)產(chǎn)生O2的體積 |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本實(shí)驗(yàn)中,測(cè)量O2的裝置是 C (填序號(hào)).

實(shí)驗(yàn)結(jié)論:在相同條件下, 雙氧水濃度越大 ,雙氧水分解得快.
丙用如圖裝置進(jìn)行實(shí)驗(yàn),通過(guò)比較 相同時(shí)間天平讀數(shù)差值大小 也能達(dá)到實(shí)驗(yàn)?zāi)康模?/p>
【考點(diǎn)】實(shí)驗(yàn)探究物質(zhì)變化的條件和影響物質(zhì)變化的因素;常用氣體的發(fā)生裝置和收集裝置與選取方法;催化劑的特點(diǎn)與催化作用.
【專題】化學(xué)實(shí)驗(yàn)與探究;壓軸實(shí)驗(yàn)題;科學(xué)探究.
【分析】根據(jù)已有的知識(shí)進(jìn)行分析,①氯酸鉀在二氧化錳的催化作用下加熱能快速的產(chǎn)生氧氣,進(jìn)行實(shí)驗(yàn)探究時(shí)要注意控制變量,
②測(cè)量氧氣的體積可以使用排水法,將排出的水的用量筒收集起來(lái),排出的水的體積就是氧氣的體積;根據(jù)表格數(shù)據(jù)即可得出影響反應(yīng)速率的因素;丙使用的是稱量剩余物質(zhì)的質(zhì)量的方法得出影響反應(yīng)速率的因素.
【解答】解:①氯酸鉀在二氧化錳的催化作用下加熱能快速的產(chǎn)生氧氣,進(jìn)行實(shí)驗(yàn)探究時(shí)要注意控制變量,故X為3.0,故填:2KClO3![]() 2KCl+3O2↑,3.0;
2KCl+3O2↑,3.0;
②要將瓶?jī)?nèi)的水排出來(lái),A和B都不可以,C可以,故填:C;
根據(jù)表格提供的數(shù)據(jù)可以看出,雙氧水的濃度越大,相同的時(shí)間產(chǎn)生氧氣的體積越大,故填:雙氧水濃度越大;
丙使用的是稱量剩余物質(zhì)的質(zhì)量的方法得出影響反應(yīng)速率的因素,根據(jù)相同時(shí)間內(nèi)天平讀書的差值大小,可以看出反應(yīng)的快慢,故填:相同時(shí)間天平讀數(shù)差值大小.
【點(diǎn)評(píng)】本題考查了影響化學(xué)反應(yīng)速率的因素,完成此題,可以依據(jù)題干提供的信息結(jié)合已有的知識(shí)進(jìn)行.

孔乙己是貧困潦倒的知識(shí)分子。在書中,孔乙己是一個(gè)知識(shí)分子,滿口“之乎者也”,但是他很窮,還竊書,說(shuō)過(guò)“讀書人的事,怎么能叫竊,”被人嘲笑,他...

自然界產(chǎn)生氧氣的化學(xué)方程式:光合作用的反應(yīng)式為6CO2+12H2O→C6H12O6+6O2+6H2O。包括光反應(yīng)和暗反應(yīng)兩個(gè)過(guò)程。需要具備光...

有的高校沒有條件,只要學(xué)業(yè)水平成績(jī)都合格就可以,比如中國(guó)科學(xué)院大學(xué)。有的需要平常學(xué)習(xí)考試成績(jī),比如北京外國(guó)語(yǔ)大學(xué)要求高三第一學(xué)期期末成績(jī)?cè)谌?..

在四則運(yùn)算中,表示計(jì)算順序,在小括號(hào)之后、大括號(hào)之前;表示兩個(gè)整數(shù)的最小公倍數(shù);表示取未知數(shù)的整數(shù)部分;在函數(shù)中,表示函數(shù)的閉區(qū)間;在線性代...

濟(jì)南開設(shè)的最好的職高學(xué)校有:濟(jì)南方信集團(tuán)職業(yè)高中、濟(jì)南公共交通職業(yè)高中。濟(jì)南市公共交通職業(yè)高級(jí)中學(xué)是由濟(jì)南市公共交通總公司承辦,業(yè)務(wù)屬濟(jì)南市...

實(shí)然:是說(shuō)事物實(shí)際上就是這樣的,但不同于現(xiàn)實(shí)性(現(xiàn)實(shí)性指其有合理性和客觀性);應(yīng)然:就是應(yīng)該是怎么樣的意思,比如說(shuō)這件事,就應(yīng)該是那樣的結(jié)果...

地中海氣候一種夏季炎熱干燥、冬季溫和多雨,雨熱不同期的氣候類型。地中海氣候冬季受西風(fēng)帶控制,鋒面氣旋頻繁活動(dòng),氣候溫和,最冷月的氣溫在4-1...

堿石灰,又稱鈉石灰,堿石灰是白色或米黃色粉末,疏松多孔,是氧化鈣(CaO,大約75%),水(H?O,大約20%),氫氧化鈉(NaOH,大約3...